超声联合微泡技术在肿瘤治疗中的研究进展
李美莺 章丽洁 陈燕君 沈俭 戴莉
( 上海中医药大学附属普陀医院,上海 200062)
摘 要 随着超声分子成像技术的飞速发展,超声联合微泡(空化效应联合微泡)成为生物医学的研究热点,应用前景广阔,有望成为一种新的安全、无创的治疗手段。目前,肿瘤治疗陷入瓶颈,如何根据现有技术及药物提高治疗效果是临床一线医师的重要课题。全文阐述超声对比剂和空化效应的发展以及超声联合微泡技术载送肿瘤药物、靶向超声微泡介导基因、超声和微泡联合化疗药物治疗肿瘤、对肿瘤血管抑制及诱导肿瘤细胞凋亡等的研究进展。
关键词 肿瘤 ;超声空化 ;微泡对比剂 ;靶向
中图分类号 :R445.1 文献标志码 :A 文章编号 :1006-1533(2019)02-0026-05
ABSTRACTWith the rapid development of ultrasonic molecular imaging technology, ultrasound combined with microbubbles (cavitations combined with microbubbles) has become a research hotspot in biomedicine, its application prospect is broad and it is expected to become a new safe and non-invasive treatment. At present, cancer treatment is in a bottleneck, and how to improve the therapeutic effect is an important topic for clinical frontline physicians according to the existing technology and drugs. The full text explains the development of ultrasound contrast agents and cavitations effects and advances in research on ultrasound combined with microbubble technology to carry tumor drugs, targeted ultrasound microbubble-mediated genes, ultrasound and microbubbles combined with chemotherapy drugs to treat tumors, tumor angiogenesis and induction of apoptosis in tumor cells.
KEY WORDS tumour; ultrasonic cavitations; microbubble contrast agent; targeting
随着超声分子成像技术的飞速发展,超声联合微泡(空化效应联合微泡)成为生物医学的研究热点,应用前景广阔,有望成为一种新的安全、无创的治疗手段。目前,肿瘤治疗陷入瓶颈,如何根据现有技术及药物提高治疗效果是临床一线医师的重要课题。本文阐述超声对比剂和空化效应的发展以及超声联合微泡技术在肿瘤治疗中的应用及效果。
1 超声对比剂的发展
超声对比剂指严格制成的、对人体无毒害的气体微泡 , 通过气泡对超声波背向散射而达到增加超声回波信号,进而提高超声成像分辨本领的技术。利用超声对比剂可提高超声成像对生物体特定疾病的诊断率。理想的对比剂应具备以下条件 [1-2] :①粒径小。微泡粒径太大不能透过毛细血管,容易造成血管堵塞。②半衰期长,体内性质稳定好。超声诊断需要一定的时间,这要求微泡对比剂在体内有足够的稳定性以保证诊断过程中不破裂。③外壳柔软且富有弹性,在低用量时即可得到良好的超声成像效果。泡膜越厚弹性越差,需要更高频率超声使微泡共振,因此产生血管破裂或组织淤血的可能性越大。④生物相容性好,不良反应少,制备方法简单,储存方便。
随着纳米技术和生物学技术的迅猛发展,超声对比剂正向着纳米级和靶向修饰的方向发展。纳米级超声对比剂较常规对比剂的优势在于具有极强的穿透力,有可能到达血管外实现超声靶向显像 [3]。纳米级超声对比剂的开发和应用使血池外成像和超声分子影像学成为可能。由于肿瘤宿主固有血管(该部分血管通透正常)Z大孔径≤ 100 nm,肿瘤新生微血管孔径可达 380 ~780 nm,纳米级超声对比剂粒径小于 700 nm,可轻松通过肿瘤新生血管孔径,在肿瘤组织中聚集,实现超声成像 [4]。另外,随着微泡尺寸的减小,物质的分子特性会发生很大的改变,表现出如表面张力增大、表面活性中心增多、吸附能力增强、不易受体内和细胞内各种酶的降解等特性,还可将超声对比剂与特异性配体连接或作为药物、基因的载体,利用超声波与对比剂的相互作用及所产生的生物学效应实现肿瘤的靶向诊断和治疗。
空化效应指通过外加能量使液体内的气核被拉开成空化气泡的现象。空化效应是一种阈效应,超声空化阈值与液体中微气泡 ( 即空化核 ) 的存在、数量及浓度密切相关。超声微泡对比剂作为人造空化核进入机体后可显著增强空化效应,其机制主要有两方面 :①因为人体内几乎不含气核,因此外加微泡可显著增加外源性空化核数量,进而增加空化效应的强度。②降低超声的空化阈值。微泡存在可减少产生空化所需的总能量,并降低引起空化效应的能量阈值。Ward 等 [5] 利用超声联合微泡作用于淋巴细胞悬浮液,发现当超声辐照剂量一定而注入微泡浓度增高或微泡浓度不变而超声辐照剂量增加,可出现两种声孔效应,一种是细胞膜上出现暂时性开放小孔,小孔关闭后,细胞能保持活性,称为可恢复性或可逆的声孔效应 ;另一种是细胞膜上形成永久开放小孔,细胞可能会丧失活性,称为致死性或不可逆的声孔效应。因此,超声联合微泡产生的可控性空化效应在治疗领域中前景广阔。
近年来,超声联合对比剂介导基因或药物靶向治疗异军突起,这是一种“不开刀、不留瘢痕、没有损伤”的新的“狙击疗法”[6]。Tinkov 等 [7] 提出利用超声破坏微泡实现药物向目标组织转移释放,从而起到靶向治疗的效果。此法可提高局部药物浓度,同时避免药物受到外部环境破坏,延缓药物释放,保持药物原有的代谢性质及降低外源性药物引起的毒副作用和免疫反应等。超声微泡还可作为载体运送细胞毒性药物,并在超声作用下破坏微泡实现药物向目标组织释放,从而起到靶向治疗的作用。已有研究证明了微泡靶向给药效果,将微泡填充药物作为载体传送癌症药物给肿瘤体,微泡受超声激励后破裂,其产生的物理效应对肿瘤具有一定破坏作用。同时,药物释放时可瞬时增加细胞渗透性,导致药物仅在局部释放,从而减少对身体的毒副作用 [8-9],Z大限度地提高治疗效果。Zhang 等 [10] 用多西紫杉醇脂质微泡联合超声触发微泡破坏,减少肿瘤细胞增殖,诱导MHC-H 细胞凋亡,显著抑制小鼠实体瘤的生长,表明用超声辐照载有抗肿瘤药物的微泡能明显提高药物的治疗功效。
微泡是一种无创、高效的新型基因载体,基因在到达病变组织前遇到的主要屏障是内皮屏障和细胞膜。研究表明,超声波破坏微泡后可引起直径≤ 700 nm 的微血管破裂,内皮细胞间隙增宽,使基因等更容易通过血管内皮到达靶组织并被吸收 [11]。靶向超声微泡介导基因(miRNA)超声微泡对比剂是以糖类、磷脂、白蛋白、高分子多聚物等物质为壳膜,包含有不同气体的球状物质 [12-13]。王玲 [14] 采用载基因荧光金微泡联合 US/NIR 双模态成像、双辐照 - 光热 - 基因治疗肝癌及其机制的研究为微泡对比剂携带抑癌基因治疗肿瘤提供了实验基础。Ji 等 [15] 将载有 miRNA-133a 的超声微泡注入乳腺癌小鼠体内,通过抑制表皮生长因子(EGF)表达和 Akt 磷酸化抑制细胞增殖,使肿瘤生长受到抑制,提高了小鼠生存率。Chowdhury 等 [16] 将 miR-122 和 miR-21 抑制剂联合高分子微泡 - 脂质体复合物(PLGA-NP)作用于离体肝细胞肝癌(HCC)细胞和在体 HCC 异种移植瘤,结果表明两种 miRNA 联合较单一 miRNA 治疗效果更好,并可导致对多柔比星有耐药性的 HCC 细胞死亡,为提高肿瘤基因治疗效果以及对化学药物产生抗性的肿瘤的治疗提供了新的思路和方法。超声微泡介导的基因转染为靶向基因治疗提供了很好的平台,能精确地将基因作用于靶器官,减少侵袭性,提高转染效率。
乔学研等 [17] 的研究表明低能量诊断超声(MI=0.3)联合微泡可以增强兔 VX2 的血流灌注,而高能量诊断超声(MI=1.4)可减少血流灌注,但均不会对组织产生明显的结构性变化,此规律可为临床工作中多种肿瘤的治疗提供可靠依据,也为超声联合微泡治疗肿瘤提供依据。仇春丽等 [18] 用超声介导自制纳米微泡联合顺铂对小鼠皮下 H22 肿瘤的抑制研究表明,超声微泡联合药物组比超声微泡组及单纯药物组的抑瘤效果更佳,抑瘤率达70.01%。超声微泡联合药物具有协同抗肿瘤效应,其机制可能是通过抑制肿瘤新生血管生成和诱导肿瘤细胞凋亡而发挥抗肿瘤作用。同时,超声辐照联合微泡能增强化疗药的药理作用,抑制瘤体生长。Sonoda 等 [19] 将黑色素瘤 B-16 细胞接种于严重联合免疫缺陷小鼠下眼睑皮下制成肿瘤模型,并采用三种方法进行治疗,结果表明单纯博来霉素组即使剂量达到 2 mg/ml,肿瘤还能逐渐生长,博来霉素 + 超声辐照组的博来霉素剂量为 0.25 mg/ml 时,肿瘤生长受抑制,超声辐照 + 白蛋白微泡组的博来霉素剂量为 0.06 mg/ml 时即能抑制肿瘤生长,认为超声联合微泡辐照能显著减少药物用量,提高化疗效果。
目前,微血管密度测定技术已公认为评价肿瘤新生血管形成的“金标准”[20-21]。肿瘤新生血管结构简单,缺乏弹力纤维层,具有管壁薄弱、基底膜不完整和通透性高等特点 [22]。超声空化效应可引起微血管的血管内皮细胞机械性损伤、基底膜断裂、胶原蛋白暴露,导致微血栓形成,栓塞或部分阻断已形成的肿瘤血管的局部血液循环和血液供应,使微血管密度减低,引起局部肿瘤细胞死亡,进而使肿瘤体积缩小,控制肿瘤进展,达到治疗目的(图 1)[23]。Lawrie 等 [24] 报道超声辐照可使裸露 DNA 对血管内皮细胞的转染率提高 l0 倍,使质粒脂质体转染法的转染效率提高 3 倍。如在空化条件下使用微泡与质粒结合,则比单纯裸质粒转染效率提高 300倍,如果空化下使用的微泡是脂质体微泡,则基因转染效率将比单纯裸质粒基因的转染效率提高 3 000 倍。Taniyama 等 [25] 用编码荧光素的质粒 DNA 体外转染人血管平滑肌细胞和血管内皮细胞,24 h 后单纯质粒组细胞荧光素活性较低,超声照射组比单纯质粒组高约 70 倍,对比剂 + 超声照射组比单纯质粒组高 7 000~8 000 倍 ;活体实验中质粒 + 对比剂 + 超声照射组比单纯质粒组细胞的荧光素活性高约 1 000 倍。Willmann 等 [26] 的研究表明,超声空化在微血管栓塞中能起到至关重要的作用,空化作用可破坏癌组织的微血管管壁和部分周围组织,激发凝血酶活性,引发大面积毛细血管形成血栓,从而切断肿瘤组织的血液供给途径。简蓉等 [27] 用超声结合微泡(静脉注射微泡)在 15 只昆明小白鼠的左后侧小腿皮下种植 S180 肉瘤细胞,结果表明肿瘤及肿瘤周围组织在微泡注射后超声显影均有明显增强,但肿瘤组织在治疗下即刻血流灌注明显减少,部分区域在治疗后 24 h 未能恢复,而肿瘤周围组织在治疗后即刻血流灌注稍有减少,在治疗后 24 h 明显恢复,证实低强度超声联合微泡通过对肿瘤及肿痛周围组织产生不同组织病理学改变继而引起差异性的血流灌注影响,而造成两者对超声空化产生不同病理反应的潜在机制是两者血管之间的成熟度差异。黄品同等 [28] 将 17 只血管内皮细胞生长因子受体2(VEFGR2)高表达的结肠癌皮下种植瘤 Balb / C 裸鼠模型分为三组,A 组 5 只为对照组,仅接受超声造影检查和假照射 ;B 组 6 只用空白脂质微泡结合超声辐照 ;C 组 6 只用载靶向 VEGFR2 单抗的脂质微泡结合超声辐照,所有模型均用红色荧光蛋白标记,空化治疗前和治疗后 1 周分别进行超声造影和荧光摄片检查,测量肿块大小、荧光面积、荧光强度及血管密度,并进行比较,结果表明微泡及靶向微泡均能增强超声去空化对肿瘤细胞的损伤和对肿瘤滋养血管的栓塞作用,但靶向微泡去空化效果更佳。
肿瘤的“饥饿疗法”是治疗无手术切除指征或术后复发肿瘤患者的首选方案,但由于受器械和操作手法限制,对于直接营养肿瘤的大量滋养血管往往束手无策。用超声破坏微泡可使肿瘤新生血管发生明显超微结构改变,引起内皮细胞线粒体肿胀、髓样变、细胞质空化等,为微泡对比剂直接治疗肿瘤提供了新方法。赵璐等 [29] 用低强度脉冲超声辐照 K562 白血病细胞,并联合 Sonovue增强超声空化效应,结果微泡参与的超声空化能直接开放 mPTP,并通过 CsA 介导通路释放 Cytc,Z终导致凋亡发生。吴晓辉等 [30] 用不同强度的低频超声联合微泡对胶质瘤进行治疗,并从组织学、免疫组化、透射电镜等不同层面观察其微结构变化,结果显示不同剂量的低强度超声对胶质瘤细胞的增殖均有抑制作用,并随超声辐射增强而增强,在 0.7 W/cm2 超声辐照后细胞凋亡率Z高,辐射细胞在透射电镜下能看见细胞褶皱、DNA 断裂、线粒体肿胀甚至空泡化等凋亡的典型改变(图 2)。体外研究证实超声空化效应可以增加细胞膜的通透性,降低细胞的迁移能力和增殖能力,可以作为药物或载体控释手段定位增加病变部位温度,而正常组织不会受到损伤,从而增加化疗药物敏感性,对肿瘤细胞的迁移能力有明显的抑制作用。
随着超声分子成像的飞速发展,超声联合微泡辐照在肿瘤治疗中有巨大的潜力,为临床肿瘤治疗提供了新的可供选择的思路。空化效应是超声辐照微泡介导基因转染的主要机制,但同时亦能产生有害的生物学效应,只有适宜的超声参数和纳 / 微泡剂量才能在不损伤细胞的前提下促进基因转染。目前,动物实验已证实纳 / 微泡可作为基因的输送载体进行基因治疗,超声联合微泡在动物实验中的研究进展相对迅速,超声靶向微泡破坏技术介导的靶向基因治疗方法既可增强裸质粒 DNA 在癌细胞内的转染和表达,又能提高基因治疗的靶向性,减少全身不良反应,超声微泡联合药物也有很多相关研究,因此,超声联合微泡是一种很有前途的临床肿瘤治疗技术。但相关研究似乎未能与临床取得一致,若用于临床尚需要大量研究评价其效果和安全性。
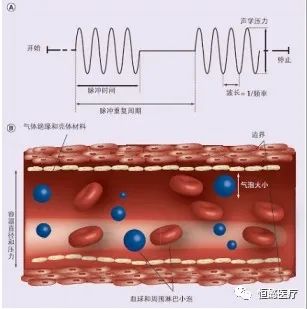
图1 微泡作用于血管产生的效应[31]
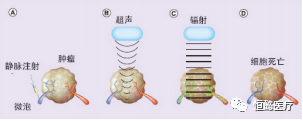
图2 超声微泡增强辐射[32]
注 :○A 微气泡通过脉管系统注入靶肿瘤○B 超声应用于声学上,刺激泡流经肿瘤微血管○C 辐射增敏在肿瘤血管内皮细胞(辐射增敏细胞显示绿色),扰动的血管对低剂量电离辐射很敏感,导致广泛辐射,肿瘤微血管塌陷○D 一种治疗方法在24 h 内导致广泛的细胞死亡,占肿瘤体积的 50%~60%.
Sonic Concepts 可提供相关超声换能器 (超声聚焦探头)及配套FUS系统硬件,满足上述要求。
更多信息请进入Sonic Concepts专区:https://www.shprimesci.com/agent/sonicconcepts/
参考文献
[1] Goldberg BB, Liu JB, Forsberg F. Ultrasound contrast agents: A review[J]. Ultrasound Med Biol, 1994, 20(4): 319-333.
[2] Maeda H, Fang J, Inutsuka T, et al. Vascular permeability enhancement in solid tumor: various factors: mechanisms involved and its implications[J]. Int Immunopharmacol, 2003, 3(3):319-328.
[3] Oeffinger BE, Wheatley MA. D e v e l o p m e n t a n d characterization of a nano-scale contrast agent[J]. Ultrasonics,2004, 42(1-9): 343-347.
[4] Moghimi SM, Hunter AC, Murry JC. Long-circulating and target-specific nanoparticle: theory to practice[J]. Pharmacol Rev, 2001, 53(2): 283-318.
[5] Ward M, Wu J, Chiu JF. Experimental study of the effects of optison concentration on sonoporaton in vitro[J]. Ultrasound Med Biol, 2000, 26(7): 1169-1175.
[6] Rapoport NY, Kennedy AM, Shea JE, et al. Controlled and targeted tumor chemotherapy by ultrasound-activatednanoemulsions microbubbles[J]. J Control Release, 2009, 138(3): 268-276.
[7] Tinkov S, Bekeredjian R, Winter G, et a1. Microbubbles as ultrasound triggered drug carriers[J]. J Pharm Sci, 2009, 98(6): 1935-1961.
[8] Ibsen S, Schutt CE, Esener S. Microbubble-mediated ultrasound therapy: a review of its potential in cancer treatment[J]. Drug Des Devel Ther, 2013, 7: 375-388.
[9] Goertz DE, Todorova M, Mortazavi O, et al. Antitumor effects of combining docetaxel(taxotere) with the antivascular action of ultrasound stimulated microbubbles[J]. PLoS One, 2012, 7(12): e52307.[10] Zhang Y, Chang RJ. Docetaxel-loaded lipid microbubbles combined with ultrasound-triggered microbubble destructionfor targeted tumor therapy in Mhcc-h cells[J]. Onco Targets Ther, 2016, 9: 4763–4771.
[11] Price RJ, Skyba DM, Kaul S, et a1. Delivery of colloidal particles andred blood eels to tissue through microvessel ruptures created by targeted mirobubble destruction with ultrasound[J]. Circulation, 1998, 98(13): 1264-1267.
[12] Lum JS, Dove JD, Murray TW, et al. Single microbubble measurements of lipid monolayer viscodlastic properties for small amplitude oscillations[J]. Langmuir, 2016, 32(37): 9410-9417.
[13] Xing L, Shi Q, Zheng K, et al. Uturasound-mediated microbubble destruction (UMMD)facilitates the delicvery of ca19-9 targeted and paclitaxel loaded mpeg-plga-pll nanoparticles in pancreatic cancer[J]. Theranostics , 2016,6(10): 1573-1587.
-
FluxData LTMS溶液浓度检测系统
LTMS溶液浓度检测系统Liquid Transmission Measurement System LTMS产品说明 LTMS 是一种适用于各种恶劣环境的溶液浓度测量系统。其可通过测量液体 样品,建立数据模型,检测实际生产中的溶液中的组分浓度. Fluxdata……
-
微米级CNC铣床
Minitech Machinery Corporation台式桌面微铣削床CNC机器专注于精密小零件制造艺术,确保每次切割都具有优异的品质和持久的价值。美国Minitech系列产品:Minitech Machinery Corp CNC Mini-Mill/2、Mini-Mill/3 、……
-
LAUDA Ecoline校验专用恒温器:应用于校准和调节温度
LAUDA Ecoline校验专用恒温器:应用于校准和调节温度,温度范围从-30到200℃ 校准和调节完整的高性能的解决方案 LAUDA校验专用恒温器为校准和调节提供了一个稳定的恒温和均一性良好的测试腔环境。根据测试所……
-
Buchi R-300旋转蒸发仪:可搭配50mL-5000mL蒸发瓶
BUCHI R-300旋转蒸发仪:方便的旋转蒸发 旋转蒸发仪 R-300 满足旋转蒸发在便捷性和多功能性方面的高要求。其模块化设计允许将 R-300 扩展成一个全集成系统,在该系统中一个中央界面调节每个组件。 蒸发瓶尺寸:50 ……
-
MicaSense RedEdge-P双光多光谱成像系统
MicaSense RedEdge-P双光多光谱成像系统 RedEdge-P多光谱产品适合多类型行业应用,能够对精农业(农作物,蔬果等),环境,林业,渔业,海洋,航空,物料筛选,考古研究,人体行为学的双光多光谱系统,双光多光谱相……
-
Fluxdata FD-D8R SCI/SCE颜色检测系统
FluxData FD-D8R是一种坚固、非接触、实时分光光度计,设计用于工业应用。它新颖,紧凑的设计允许测量颜色,包括和排除镜面反射组件使用漫射照明和8°测量角度,无需连接到光纤。 该系统根据标准快速测量颜色,结果……
-
高压灭菌器加热故障如何处理?高压灭菌器在使用时的注意要点
浅析高压灭菌器在使用时的那些注意要点 高压灭菌器是用比常压高的压力,把水的沸点升至100℃以上的高温,而进行液体或器具灭菌的一种高压容器。高压灭菌器应用范围:高压灭菌器系列产品是利用压力饱和蒸汽对产品进……
-
HIFU TPO200深度聚焦超声刺激系统/磁兼容聚焦超声刺激
SONIC CONCEPTS HIFU TPO200 SYSTEM 深度聚焦系统的换能器均采用环形外延设计、超低损耗线缆和完善的阻抗匹配电路系统,并将其整体置入换能器内部,从而确保换能器的完整性和统一性. 外部尺寸非常精巧,亦适合……
-
Drummond Nanoject II 自动纳升注射器
精细的程序需要高超的技术 Nanoject II Auto-Nanoliter Injector 提供了重要的选项和控制,非常适合对卵母细胞、胚胎和组织进行超精细的工作。注射量范围在 2.3 纳升和 69.0 纳升之间,有 16 种可选增量。 可选速……


